
中大新聞網訊(通訊員陳俊)惡性腫瘤的免疫治療因T細胞浸潤不足在實體瘤中受限,而巨噬細胞作為腫瘤微環境的核心組分,其功能調控成為關鍵突破口。中山大學中山醫學院陳俊團隊前期發現靶向巨噬細胞免疫檢查點(如Siglec-9、SIRPα)可重塑免疫抑制微環境(Nature Cancer, 2023; 2024)。因此,重塑巨噬細胞主導的免疫抑制微環境,將為開發新型免疫聯合療法提供重要突破口。
2025年3月22日,陳俊團隊在Science Advances在線發表了題為“AMPK-dependent Parkin activation suppresses macrophage antigen presentation to promote tumor progression”的研究論文。該研究首次揭示了腫瘤相關巨噬細胞(TAMs)中的Parkin通過抑制巨噬細胞提呈抗原促進實體腫瘤免疫逃逸的功能機制,闡明了Parkin分子的新功能。
該研究首先通過構建多種小鼠腫瘤模型,發現Parkin敲除小鼠(Park2-/-)可顯著抑制腫瘤生長。進一步進行單細胞轉錄組測序分析、流式細胞術及TCR測序,并構建了Parkin巨噬細胞條件性敲除小鼠(Park2fl/fl-Lyz2-Cre+/-),該研究發現Parkin 敲除增強了TAMs中MHC-I表達和抗原遞呈,進而促進T細胞的活化、TCR擴增、細胞增殖及浸潤,從而控制腫瘤進展與復發。通過對機制的探索,研究者構建了Parkin蛋白點突變的巨噬細胞及巨噬細胞自噬缺陷的條件性敲除小鼠(Atg5fl/fl-Lyz2-Cre+/-),明確了TAMs中AMPK 激活Parkin的E3泛素連接酶活性,調控ATG5依賴性的自噬作用下調巨噬細胞 MHC-I的表達,導致呈遞腫瘤抗原不足,削弱了抗腫瘤免疫反應。
治療策略方面,該研究發現Parkin敲除的巨噬細胞過繼回輸可抑制免疫缺陷小鼠的腫瘤進展,表明其獨立于T細胞發揮抗腫瘤作用。聯合PD-L1單抗治療可協同增強療效,提示靶向Parkin的細胞治療具有轉化潛力。該研究為開發基于巨噬細胞抗原提呈的新型免疫療法提供了理論依據。
綜上所述,該研究闡明了AMPK 激活Parkin通過ATG5依賴性的自噬作用下調巨噬細胞 MHC-I的表達,削弱了巨噬細胞對腫瘤抗原呈遞,進而抑制了抗腫瘤免疫反應(圖1)。揭示了Parkin作為巨噬細胞抗原遞呈抑制因子的新功能,其靶向策略能夠促進巨噬細胞活化T細胞從而抵抗免疫逃逸。
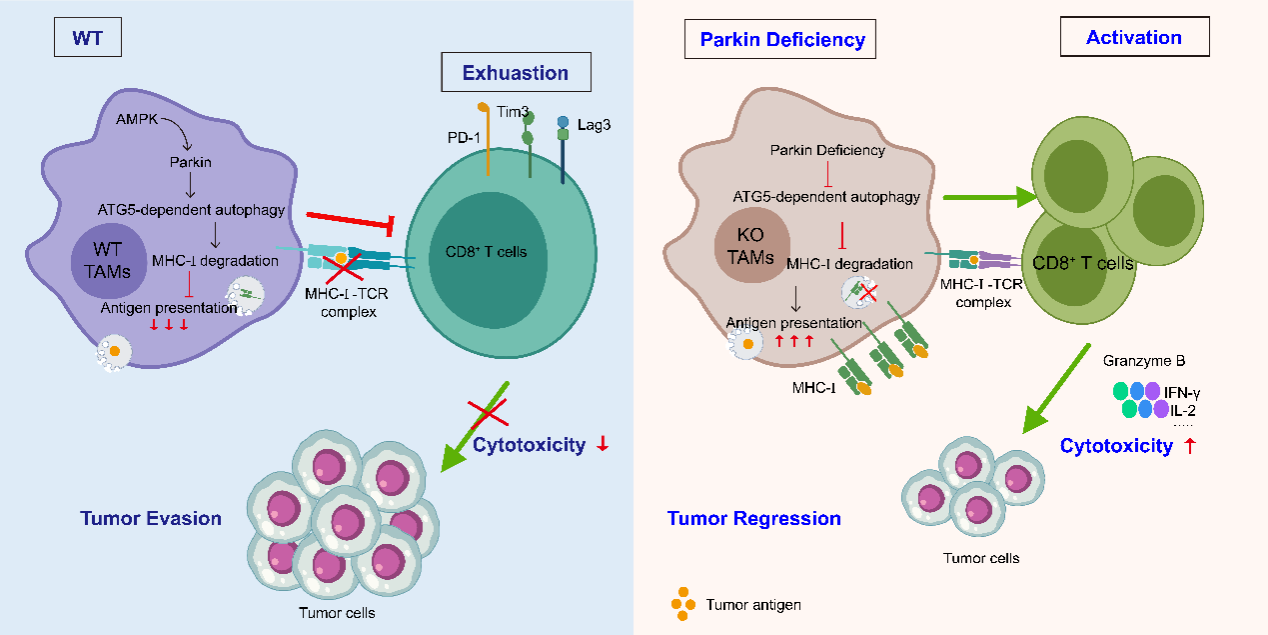
圖1. 機制示意圖
中山大學中山醫學院博士后王馨語、博士畢業生李懿逸為該論文共同第一作者。陳俊教授、廣州醫科大學廖靜教授及博士后王馨語為論文的共同通訊作者。
該研究得到科技部重點研發項目、國家自然科學基金委原創探索項目及面上項目和青年項目、廣東省“珠江人才計劃”等項目資助。該研究得到中山大學鄭利民教授、蔡衛斌教授,四川省腫瘤醫院歐娟娟教授,澳大利亞昆士蘭大學余迪教授,及加拿大麥吉爾大學Edward Fon教授、Jean-Fran?ois Trempe教授的大力協助。動物實驗依托于中山大學實驗動物中心完成。中山大學為論文第一單位。
原文鏈接:https://www.science.org/doi/10.1126/sciadv.adn8402
文稿終審:郝雅娟